Abstract
Chamomile Matricaria recutita (L.) is an ancient healing plant; it is used for a sore stomach, a mild laxative, anti-inflammatory and a gentle sleep aid. Chamomile plants are infested by chamomile stem-weevil Microplontus rugulosus (Col., Curculionidae) and chamomile smooth beetle Olibrus aeneus (Col., Phalacridae), and can lead to a high reduction in chamomile yield. This work aimed to survey M. rugulosus and O. aeneus by different monitoring methods as well as to manage them by using entomopathogenic nematodes.
Sweep nets, water traps, and dissecting the chamomile stems and flowers were used to monitor for M. rugulosus and O. aeneus. Chamomile insects were collected from naturally infested plants moved from the field to the greenhouse. Management of chamomile insects was conducted using three strains of entomopathogenic nematodes; while the control plants were sprayed only with water. Each strain was replicated three times and each replicate included 50 chamomile plants (combined total was 150 for each strain). Three treatment dates were carried out in May, June and July; the first one was mainly for controlling stem weevil, while the other two dates were for smooth beetle.
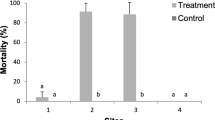
The results showed that 70–80 % of stems had damage and symptoms of stem weevils. Thirty percents from the investigated plants were larvae free of smooth beetle; whiles 70 % was infested with different classifications (e. g. 1, 2, 3, 4 or more than 4 larvae/blooms). The results confirm that smooth beetle infestation and larval numbers were higher in May and June than July. Steinernema carpocapsae had more efficiency than S. feltiae and Heterorhabditis bacteriophora in controlling both insects. Entomopathogenic nematodes could be one of the effective management strategies to control these insects in the chamomile fields.
Zusammenfassung
Kamille Matricaria recutita (L) ist eine alte Heilpflanze und wird als ein mildes Abführmittel, entzündungshemmendes Mittel und sanfte Einschlafhilfe verwendet. Kamille- pflanzen werden von vielen Insektenschädlingen befallen. Die Blütenköpfe werden vom Kamilleglattkäfer Olibrus aeneus (Fabricius 1792) geschädigt. Einen Stängelbefall verursacht der Rüsselkäfer Microplontus rugulosus (Herbst 1795). Die Arbeit verfolgte das Ziel, den Feldbefall und das Schadausmaß unter Produktionsbedingungen zu erfassen und Hinweise zur biologischen Bekämpfung der Schädlinge unter Laborbedingungen zu erarbeiten. Weiterhin sollten unter den aktuellen Bedingungen des Klimawandels das Gefährdungspotenzial dieser Schaderreger für den Kamilleanbau in Mitteldeutschland eingeschätzt werden, um Hinweise zum integrierten Pflanzenschutz zu formulieren. Die Untersuchungen wurden 2014 im Unternehmen Agrarprodukte Ludwigshof eG durchgeführt. Die Studiendaten wurden im Rahmen einer Kooperationsvereinbarung realisiert.
Als Überwachungsmethoden zur Ermittlung der Populationsdynamik der Schädlinge (M. rugulosus und O. aeneus) wurden der Kescher und Wasserfallen verwendet. Die Stängel- und Blütenbonitur diente der Ermittlung des Larvenbefalls. Der Laborversuch zur Bekämpfung wurde mit 3 Stämme von entomopathogenen Nematoden durchgeführt, während die Kontrollpflanzen nur mit Wasser besprüht wurden. Der Versuch erfolgte in dreifacher Wiederholung mit jeweils 50 Kamillepflanzen (total 150 Proben für jeden Nematoden Stamm). Drei Behandlungsdaten wurden im Mai, Juni und Juli realisiert; der erste Termin diente der Rüsselkäferbekämpfung, während an den anderen die Bekämpfung der Glattkäfer erfolgte.
Die Ergebnisse zeigten, dass 70–80 % der Stängelproben eine Pflanzenschädigung aufwiesen oder Symptome der Rüsselkäferlarven zeigten. Dreißig Prozent der untersuchten Pflanzen waren frei von Käferlarven; aber 70 % waren in verschiedenen Schadklassen (1, 2, 3, 4 oder mehr als 4 Larven/Blüten) befallen. Die Ergebnisse bestätigen, dass der Käferbefall und die Larvenzahlen im Mai und Juni höher waren als im Juli. Der entomophage Nematode Steinernema carpocapsae hatte mehr Effizienz als die Arten S. feltiae und Heterorhabditis bacteriophora. Die Überlebensrate der Larven war am höchsten in der unbehandelten Kontrolle. Die Studie zeigt, dass der Einsatz entomopathogener Nematoden (EPNS) eine effektive Managementstrategie sein könnte, um Schadinsekten in Kamille beständig zu regulieren und es wäre eine geeignete Regelstrategie im Rahmen des integrierten Pflanzenschutzes.







Similar content being viewed by others
References
Albert R, Allgaier C, Schneller H, Schrameyer K (2007) Biologischer Pflanzenschutz im Gewächshaus. Ulmer, Stuttgart
Bacher S (1994) Strategien einer biologischen Bekämpfung der Geruchlosen Kamille in Kanada. Z Pflanzenkrankh Pflanzenschutz Sonderheft XIV:221–230
Berry RE, Liu J, Groth E (1997) Efficacy and persistence of Heterorhabditis marelatus against root weevils in strawberry. Environ Entomol 26:465–470
Bhaskaran N, Shukla S, Srivastava JK, Gupta S (2010) Chamomile: an anti-inflammatory agent inhibits inducible nitric oxide synthase expression by blocking RelA/p65 activity. Int J Mol Med 26:935–940
Blum H, Meyer U, Planer J, Pude R, Gärber U, Krusche M (2010) Praxisleitfaden Krankheiten und Schädlinge im Arznei- und Gewürzpflanzenanbau. DPG Selbstverlag, Braunschweig, p 184
Chen S, Han X, Moens M (2003) Biological control of Delia radicum with entomopathogenic nematodes. Appl Entomol Zool (Jpn) 38:441–448
Dachler M, Pelzmann H (1989) Arznei- und Gewürzpflanzen: Anbau, Ernte, Aufbereitung, 1st edn. vol. 40. Österreichischer Agrarverlag Wien, Klosterneuburg
Dachler M, Pelzmann H (1999) Arznei- und Gewürzpflanzen: Anbau, Ernte, Aufbereitung, 2nd edn. Österreichischer Agrarverlag Wien, Klosterneuburg
El-Wakeil NE, Volkmar C (2011) Effect of weather conditions on frit fly (Oscinella frit, Diptera: Chloropidae) activity and infestation levels in spring wheat in central Germany. Gesunde Pflanzen 63:59–165
El-Wakeil NE, Volkmar C (2013) Efficacy of entomopathogenic nematodes against the frit fly Oscinella frit (L.) (diptera: Chloropidae) on spring wheat. J Kulturpflanzen 65:9–18
Freese A, Günther W (1991) Olibrus aeneus Fab. (Col., Phalacridae), a species associated with Tripleurospermum perforatum (Mérat) Wagenitz and other Anthemideae (Asteraceae) and its potential for biological control. J Appl Entomol 111:499–505
Gerlach W, Westermeier G, Stoiber B, Engert C, Thesing M (2008) Krankheiten und Schädlinge an Stauden. CD. Staatliche Forschungsanstalt für Gartenbau, Weihenstephan
Hoppe B et al (2007) Handbuch des Arznei- und Gewürzpflanzenanbaus. Krankheiten und Schädigungen an Arznei- und Gewürzpflanzen in verschiedenen Entwicklungstadien und nach sichtbaren Symptomen, vol. 3. (75 Farbtafeln)
Kaya HK, Gaugler R (1993) Entomopathogenic nematodes. Annu Rev Entomol 38:181–206
Kingsolver JG (1989) Weather and the population dynamics of insects: integrating physiological and population ecology. Physiol Zool 62:314–334
Kuhlmann U, Mason PG (2003) Use of field host range surveys for selecting candidate non-target species for physiological host specificity testing of entomophagous biological control agents. In: Sands D, Bellows T, Hoddle M, Hackett K, Heinz K, Reardon R (eds) USA 1st Internat Symp on Biol Cont Arthropods, Honolulu, January 14–18, 2002, Hawaii, pp 370–377 (USDA Forest Service Publication FHTET-03-05)
Kühne S, Burth U, Marx P (2006) Biologischer Pflanzenschutz im Freiland: Pflanzengesundheit im Ökologischen Landbau. Ulmer, Stuttgart
Van Lenteren JC, Bigler F, Burgio G, Hokkanen HMT, Thomas MB (2002) Risks of importation and release of exotic biological control agents: how to determine host specificity? IOBC WPRS Bull 25:281–284
Lindblad M, Sigvald R (1999) Frit fly infestation of oats in relation to growth stage and weather conditions at oviposition. Crop Prot 18:517–521
Mason PG, Kuhlmann U (2002) Regulations are necessary for biological control agents. IOBC/WPRS Bull 25:165–171
McKay DL, Blumberg JB (2006) A review of the bioactivity and potential health benefits of chamomile tea Matricaria recutita L. Phytother Res 20:519–530
Meier U (2001) Growth stages of mono-and dicotyledonous plants, 2nd edn. The Federal Biological Research Centre for Agriculture and Forestry, Berlin Braunschweig, p 158
Menéndez R (2007) How are insects responding to global warming? Tijdschr Entomol 150:355–365
Meyer U, Blum H, Gärber U, Hommes M, Pude R, Gabler J (2010) Praxisleitfaden “Krankheiten und Schädlinge im Arznei- und Gewürzpflanzenanbau”. DPG Spectrum Phytomedizin, Selbstverlag, Lebenshilfe Braunschweig gGmbH, Braunschweig
Mielke H, Schöber-Butin B (2007) Heil- und Gewürzpflanzen: Anbau und Verwendung vol. 411. Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin-Dahlem, pp 129–132
Molyneux AS (1985) Survival of infective juveniles of Heterorhabditis spp., and Steinernema spp. at various temperatures and their subsequent infectivity for insects. Rev Nematol 8:165–170
Nidagundi R, Hegde L (2007) Cultivation prospects of German chamomile in south India. Nat Prod Radianc 6:135–137
Oestergaard J, Belau C, Strauch O, Ester A, Rozen K, Ehlers R‑U (2006) Biological control of Tipula paludosa using entomopathogenic nematodes (Steinernema spp.) and Bacillus thuringiensis subsp. Israelensis. Biol Control 39:525–531
Richter E (2009) Nützlingseinsatz im Zierpflanzenbau unter Glas – Handbuch zum praktischen Arbeiten. Ergebnisse aus den Verbundvorhaben “Nützlinge I” und “Nützlinge II”. DPG-Selbstverlag, Braunschweig
Simpson BB (2001) Herbal remedies economic botany plants in our World, 3rd edn. Mc Graw-Hill, Boston, New York, Bangkok, pp 39–43
Tayel AA, El-Tras WF (2009) Possibility of fighting food borne bacteria by Egyptian folk medicinal herbs and spices extracts. J Egypt Public Health Assoc 84:21–32
Thomas CR, Maurice SC (2008) Managerial Economics, 9th edn. McGraw-Hill, Irwin (http://www.statistix.com)
Wapshere AJ (1974) A strategy for evaluating the safety of organisms for biological weed control. Ann Appl Biol 77:201–211
Acknowledgements
This work was financially supported by Martin Luther-University Halle-Wittenberg cooperated with Agrarprodukte Ludwigshof eG. We gratefully acknowledge the constructive comments on this manuscript by Dr. N. Schmidt (Pioneer Hi-Bred, USA). The authors appreciate Prof. R. Ehlers (e-Nema GmbH, Germany) for providing us Entomopathogenic nematodes.
Author information
Authors and Affiliations
Corresponding author
Rights and permissions
About this article
Cite this article
Gaafar, N., El-Wakeil, N., Abdel-Moniem, A. et al. Field Monitoring and Efficacy of Entomopathogenic Nematodes Against Chamomile Stem Weevil Microplontus rugulosus and Chamomile Smooth Beetle Olibrus aeneus Under Greenhouse Conditions. Gesunde Pflanzen 68, 163–171 (2016). https://doi.org/10.1007/s10343-016-0373-5
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s10343-016-0373-5